見出し
今日の勉強内容
いつも勉強を終える時間になっても”残業”をしていた結果、なんとか今日中にMECの臓器別完成講座 血液のテキストの復習が終わりました。A問題+★問題だけとはいえ、150問くらいはある気がします。
明日からは内科の続きとしてMEC 循環器の復習を開始する予定。分量にして血液の1.5倍くらいあるけど、何とか4日間くらいで終えたいところです。
以下は今日の勉強ノート
§6 リンパ腫・骨髄腫
リンパ腫とはリンパ球由来の腫瘍がリンパ節や臓器で増殖し、腫瘤を形成する疾患のこと。同様の腫瘍細胞が骨髄や末梢血中の増殖を中心とする場合は白血病と呼ばれ、両者は連続性の概念といえる。
Hodgkinリンパ腫(HL)
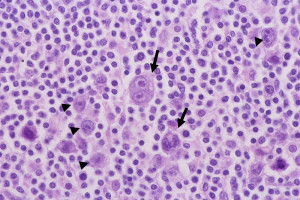
Hodgkin細胞やRS細胞と呼ばれる巨細胞(下写真)の増殖を特徴とするB細胞系リンパ腫。さらに4つの型に分類される
source:2.リンパ節 (4)ホジキンリンパ腫(結節硬化型、混合細胞型)|病理コア画像
若年性と高齢者の二峰性分布をとる。日本では悪性リンパ腫の5%程度と少ないが、欧米では30%を占める。(CLLもそうだが、欧米はリンパ系腫瘍が多い)
症状としては頚部の無痛性リンパ節腫脹で始まることが多く、B症状(体重減少・発熱・寝汗)を伴う。発熱の熱型はPel-Ebstein型間欠熱として知られる。
検査
・可溶性IL-2受容体が増加する
可溶性IL-2受容体はTリンパ球の活性化により血中に出現する(IL-2と結合することでその活性を抑える役割を持つ)蛋白であり、悪性リンパ腫や成人T細胞白血病/リンパ腫で高値となる。ウイルス感染や結核、膠原病でも上昇するため診断特異度は高くはないが、病勢を反映するマーカーとして用いられる。
・リンパ球の低下に伴い細胞性免疫が低下する(ツ反陰転化など)
治療
B症状の有無と腫瘍が存在するリンパ節の領域により分類されるAnn Arbor分類がある。この分類で早期なら化学療法(ABVD療法)+区域放射線照射、進行期なら化学療法を行う。
ABVD療法:アドリアマイシン+ブレオマイシン+ビンブラスチン+ダカルバジン
非Hodgkinリンパ腫と比べて予後は良好とされ、また若年者に多いことから二次発がんのリスクを考慮する必要がある。
非Hodgkinリンパ腫(NHL)
NHLはHL以外の悪性リンパ腫の総称であり多くの疾患を含んでいるが、びまん性大細胞型B細胞リンパ腫(DLBCL)・濾胞性リンパ腫(FL)・MALTリンパ腫などが代表的。DLBCLがNHLの30〜40%、FLが7〜15%とされる。
HLと比べてリンパ節外(Waldeyer輪・消化管)に発生する比率が高い。
・血管内大細胞型B細胞リンパ腫(IVL)
DLBCLの亜型で腫瘤形成を伴わないもの。不明熱の原因となる←いつかのドクターGで見た気がする
治療
化学療法としてはCHOP(シクロホスファミド・ヒドロキシドキソルビシン・オンコビン・プレドニゾロン)療法が用いられる。B細胞型腫瘍の場合はこれにCD20モノクローナル抗体であるリツキシマブを追加する。
進行が遅いindolent lymphoma(FLなど)の早期では化学療法を行っても予後は改善されないとして経過観察(watchful waiting)されることもあったが、リツキシマブの登場以降その比率は減少している。
・特殊な治療
MALTリンパ腫(胃に初発しやすい)は発症にピロリ菌が関与するとされ、ピロリ菌の除菌で治癒するケースも多い。
皮膚T細胞腫瘍である菌状息肉症にはPUVA療法が有効(局面期まで)。
・イブリツモマブ
リツキシマブに放射性同位体元素を結合させた薬剤
血球貪食症候群
悪性リンパ腫や感染(EBウイルス・マイコプラズマ)をきっかけとして活性化されたT細胞がサイトカインを放出し、マクロファージによって自己の血球が貪食されてしまうことによる症候群。血球減少によりDICを合併することがある。
診断には骨髄でのマクロファージによる血球貪食像を証明する。治療としてはステロイドやシクロスポリンによる免疫抑制が行われる。
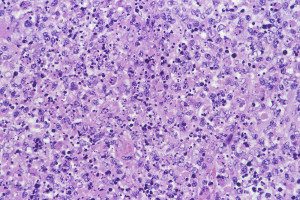
壊死性リンパ節炎(菊池病)
圧痛を伴う原因不明のリンパ節炎で、病理的には壊死像と大型のリンパ球・組織球の増殖を認める(好中球の浸潤はない)。異型リンパ球が出現することもある
source:2.リンパ節 (1)組織球性壊死性リンパ節炎|病理コア画像
多くは1〜3ヶ月以内に自然治癒する
多発性骨髄腫(MM)
骨髄における形質細胞の腫瘍性増殖による疾患。形質細胞は異常免疫グロブリン(M蛋白)を産生し、これが障害を引き起こす(診断上も重要となる)。
M蛋白の種類としてはIgG型・IgA型・Bence-Jones型などがある。
症状
- 形質細胞が産生する破骨細胞活性化因子により、骨融解をきたす→高Ca血症(Calcium elevation)&骨病変(Bone lesion)
- 骨髄腫腎(後述)→腎障害(Renal dysfunction)
- 正常造血は抑制され、汎血球減少となる→溶血(Anemia)
4つ合わせてCRABと呼ばれる
検査
- 血清蛋白電気泳動:M蛋白によるM peakが見られる。MMの診断に有効だが、M蛋白がどの型なのかは解らない
- 免疫電気泳動:M蛋白がどの免疫グロブリンに由来するのかを調べる。なおBence-Jones型の場合は尿蛋白を検体に用いる。
総蛋白は上昇することが多いが、Bence-Jones型の場合は尿から出てしまい上昇しないので注意。また尿定性(試験紙法)でも引っかかりにくい。
治療
無症候性の場合は経過観察。
臓器症状を伴っている場合はボルテゾミブ(プロテアソーム阻害薬)が用いられる。サリドマイドやその誘導体であるレナリドミドも有効とされる。65歳未満では化学療法よりも奏効率が高いことから自己末梢血幹細胞移植(AHSCT)を行う。
メルファラン・プレドニゾロンを用いたMP療法も行われるが、メルファランは造血幹細胞に対して毒性があるためAHSCTを行う症例では採取を行うまで使用しない。
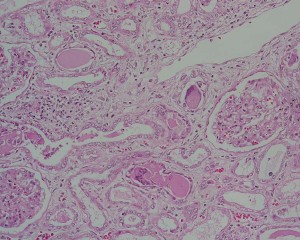
骨髄腫腎
尿細管上皮を障害&円柱形成により尿細管の閉塞をきたし(cast nephropathy)、Ⅱ型RTAの原因となる。またBence-Jones型蛋白の場合はALアミロイドーシスの原因ともなりえる。
なお多発性骨髄腫の予後には血清β2ミクログロブリンとアルブミン値が用いられ、双方とも腎障害と深い関わりがある。
source:Disease
※MGUS
M蛋白が血中に存在しているものの、無症状でありその量も少ない(M蛋白≦3g/dl)場合このように呼ばれる。MMに移行する例があるため経過観察が必要
原発性マクログロブリン血症
IgMを分泌するリンパ形質細胞腫瘍。MMと比べて骨病変は少ないが、IgMは五量体と大型であるため過粘稠度症候群を引き起こしやすい。
過粘稠度症候群
赤血球とマクログロブリンの結合により、血液の粘稠度が高くなり血流障害が生じる。これにより神経症状(末梢神経障害)・眼症状(眼底静脈のソーセージ様怒張)などをきたす。
末梢血では赤血球の連銭形成が認められる
治療としては血漿交換が有効
§7 血小板の異常
特発性血小板減少性紫斑病(ITP)
何らかの原因で抗血小板抗体が生じ、血小板が破壊される。小児の急性型(6ヶ月以内に寛解)では風疹などのウイルスによる先行感染を伴うことが多いが、成人女性に多い慢性型では先行感染を認めないことが多い。
抗血小板抗体はIgG抗体であるため、新生児に胎盤を介して移行し症状をきたすことがある。
治療
血小板数が3万/μL以上で臨床症状を認めない場合は経過観察とする。
積極的治療を行う場合は、(陽性の場合)H.pylori除菌→ステロイド→脾摘→免疫抑制剤・TPO受容体作動薬・リツキシマブ(抗体産生を抑制する)
※抗血小板抗体は血小板の破壊亢進と同時に血小板産生の抑制にも関与し、血小板が減少しているにもかかわらずTPOの値は高値となっていない(ので治療に受容体作動薬を用いる)。
手術・分娩前など止血の必要性が高い時にはIVIG療法を用いる。マクロファージがγ-グロブリンを貪食するのに使われるため、血小板破壊が抑制されると言われている。
血小板輸血は禁忌ではない(↔TTP)。ただ血小板輸血を行うと抗HLA抗体が生じるリスクがあるため、出血傾向がない場合は血小板が少なくても安易に輸血しない。そもそも輸血されても破壊されてしまうので効果は薄い
先天性血小板機能異常症
血小板による一次止血は粘着→放出→凝集から成り立ち、このうちのどこかが欠損することで血小板の機能低下をきたす疾患群。いずれも治療は対症療法が中心。
Bernard-Soulier症候群
血小板膜蛋白GPⅠb/Ⅸ/Ⅴ複合体(vWF受容体)の機能低下により、血小板とvWFの粘着能が障害された疾患。遺伝形式は常染色体劣性遺伝。末梢血中の巨大血小板出現が特徴的。
ストレージプール病
血小板の放出物質(顆粒)の欠如により、血小板の放出能が障害された疾患。
血小板無力症(Glanzmann病)
血小板膜蛋白GPⅡb/Ⅲaの機能低下により、血小板の凝集が障害された疾患。遺伝形式は常染色体劣性遺伝。
血栓性血小板減少性紫斑病(TTP)
vWFを分解する酵素ADAMTS13の活性低下により巨大vWFが出現し、これによる血小板血栓の多発から赤血球の破壊(溶血)・神経症状・腎障害などをきたす疾患。
原因としては先天性のものと、後天性(薬剤や膠原病をきっかけにADAMTS13に対する自己抗体ができる)のものがある。
症候としては意識障害が重要。
治療
血漿交換が有効。自己抗体の除去(後天性)・ADAMTS13の補充・巨大vWF除去が一度に行えるため、この治療法の導入により予後が大幅に改善した。
※血小板輸血は血小板血栓を悪化させるため禁忌
§8 凝固系の異常
血友病
先天的に第Ⅷ/Ⅸ因子(それぞれ血友病A/B)の活性が低下し、出血傾向をきたす疾患。遺伝形式は伴性劣性遺伝だが、突然発症例もある。血友病AとBの割合は5:1程度。
治療
第Ⅷ/Ⅸ因子の補充が行われる。
しかし繰り返し補充することで凝固因子に対するインヒビターが発生してしまう。この場合は第Ⅷ/Ⅸ因子が関与する経路をバイパスして止血させるバイパス療法が行われる。この時使われるノボセブンはきわめて高い止血作用を持つと言われる。
参考:血液・呼吸器内科のお役立ち情報:ノボセブン(遺伝子組換え活性型第VII因子製剤):究極の止血剤。
※後天性血友病A
抗凝固因子(第Ⅷ因子が多い)に対する自己抗体が何らかの理由で産生されることから、血友病と類似した症状を示す疾患。基礎疾患として膠原病や悪性腫瘍を持つ例が多い。
ビタミンK欠乏症
ビタミンKは食事による摂取(脂溶性のため胆汁酸が吸収に必要)と腸内細菌による産生で保たれる。
ビタミンK依存性凝固因子の中では第Ⅶ因子が最も半減期が短いため、PTはより影響されやすい。ワーファリン服用者で測定するのもPT-INR
von Willebrand病(vWD)
vWFの量的・質的異常により血小板の粘着能が障害される。またvWFは第Ⅷ因子安定化も行うため、APTTも延長する。
治療としてはデスモプレシンの投与(血管内皮からのvWF放出を刺激する)や第Ⅷ因子製剤の補充を行う。血友病で使用される遺伝子組み換え型にはvWFが含まれていないため、献血型を用いる。
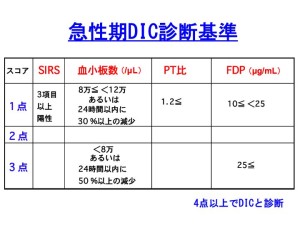
播種性血管内凝固症候群(DIC)
様々な基礎疾患を基盤として、微小血管の血栓形成・凝固因子の消耗・線溶反応の活性化などにより出血傾向をきたす症候群。基礎疾患によって凝固優位型(敗血症など)と線溶優位型(APLなど)に分けられる。
検査
SIRS・血小板数・FDP・PT比により診断されるもの(日本救急医学会作成)など、様々な診断基準がある。
source:血液・呼吸器内科のお役立ち情報:急性期DIC診断基準とは:救急領域(図解42)
Dダイマーは安定化フィブリンがプラスミンにより分解されて生じるため、Dダイマー/FDP比の増加は凝固優位型を、減少は線溶優位型を示唆する。
治療
- 抗凝固療法:ヘパリン+アンチトロンビン・遺伝子組み換えトロンボモジュリン製剤・蛋白分解酵素阻害薬(凝固因子を不活化する)
- 補充療法:血小板やFFPを補充する
※凝固優位型か、線溶優位型かにより治療選択は異なってくる